Ethanol là gì? Lợi ích của ethanol trong cuộc sống hằng ngày
-
ETHANOL
- Ethanol, còn được biết đến như là rượu ethylic, alcohol ethylic, rượu ngũ cốc hay cồn, là một hợp chất hữu cơ nằm trong dãy đồng đẳng của alcohol, dễ cháy, không màu, là một trong các rượu thông thường có trong thành phần của đồ uống chứa cồn .
- Ethanol là một alcohol mạch hở, công thức hóa học của nó là C2H6O hay C2H5OH. Một công thức thay thế khác là CH3-CH2-OH thể hiện carbon ở nhóm methyl (CH3–) liên kết với carbon ở nhóm methylen (–CH2–), nhóm này lại liên kết với oxy của nhóm hydroxyl (–OH). Nó là đồng phân nhóm chức của dimethyl ether. Ethanol thường được viết tắt là EtOH, sử dụng cách ký hiệu hoá học thường dùng đại diện cho nhóm ethyl (C2H5) là Et.
Ethanol 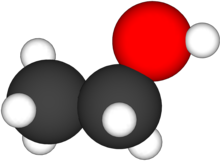 Cấu trúc phân tử của ethanol
Cấu trúc phân tử của ethanolTổng quan Danh pháp IUPAC Ethanol Tên khác Rượu ethylic
cồn
hydroxyethane (hydroxyethan)Công thức phân tử C2H5OH hay C2H6O Phân tử gam 46,07 g/mol Biểu hiện Chất lỏng trong suốt Số CAS [64-17-5] ChemSpider 682 ChEBI 16236 RTECS KQ6300000 Số EC 200-578-6 Thuộc tính Tỷ trọng và pha 0,789 g/cm³, lỏng Độ hòa tan trong nước Trộn lẫn hoàn toàn Nhiệt độ nóng chảy -114,3°C (158,8 K) Điểm sôi 78,4°C (351,6 K) pKa 15,9 (H+ từ nhóm OH) Độ nhớt 1,200 cP ở 20°C Khác MSDS Tại đây Các nguy hiểm chính Chất dễ cháy (F) NFPA 704 


Điểm bắt lửa 13°C Rủi ro/An toàn R: 11
S: 2, 7, 16Số RTECS KQ6300000 Dữ liệu hóa chất bổ sung Cấu trúc & thuộc tính n εr, v.v. Dữ liệu nhiệt động lực Các trạng thái
rắn, lỏng, khíDữ liệu quang phổ UV, IR, NMR, MS Các hợp chất liên quan Các hợp chất tương tự Methanol
1-PropanolCác hợp chất liên quan Ethylamin, Ethyl chloride,
Ethyl bromide, ethalthiol
Ethylen glycol, Ethanolamin,
2-chloroethanol
Acetaldehyde, Acid aceticNgoại trừ có thông báo khác, các dữ liệu
được lấy ở 25 °C, 100 kPa
Thông tin về sự phủ nhận và tham chiếu -
Lịch sử
- Ethanol đã được con người sử dụng từ thời tiền sử như là một thành phần gây cảm giác say trong đồ uống chứa cồn. Các cặn bã khô trong các bình gốm 9000 năm tuổi tìm thấy ở miền bắc Trung Quốc đã gián tiếp cho thấy việc sử dụng các đồ uống chứa cồn trong số những người sống ở thời kỳ đồ đá mới. Việc chiết nó ra dưới dạng tương đối nguyên chất đã được thực hiện lần đầu tiên bởi các nhà giả kim thuật Hồi giáo và họ là những người đã phát triển ra nghệ thuật chưng cất rượu trong thời kỳ của chế độ khalip (vua chúa Hồi giáo) thời kỳ Abbasid. Các ghi chép của Jabir Ibn Hayyan (Geber) (721-815) đã đề cập tới hơi dễ cháy của rượu được đun sôi. Al-Kindī (801-873) cũng đã miêu tả rõ ràng quá trình chưng cất rượu. Việc chưng cất ethanol ra khỏi nước có thể tạo ra các sản phẩm chứa tới 96% ethanol. Ethanol nguyên chất lần đầu tiên đã thu được vào năm 1796 bởi Johann Tobias Lowitz, bằng cách lọc ethanol chưng cất qua than củi.
- Antoine Lavoisier đã mô tả ethanol như là một hợp chất của carbon, hydro và oxy, và năm 1807, Nicolas-Théodore de Saussure đã xác định được công thức hóa học của nó. Năm 1858, Archibald Scott Couper đã công bố công thức cấu trúc của ethanol: điều này làm cho ethanol trở thành một trong các hợp chất hóa học đầu tiên có sự xác định cấu trúc hóa học.
- Ethanol lần đầu tiên được Michael Faraday tổng hợp nhân tạo vào năm 1825. Ông phát hiện rằng acid sulfuric có thể hấp thụ một lượng lớn khí than. Ông đưa ra kết quả lời giải cho Henry Hennel ở Anh, người đã phát hiện ra ethanol có trong “acid sulphovinic” (ethyl hydro sulfat). Năm 1828, Hennell và nhà hóa học Pháp Georges-Simon Sérullas đã phát hiện một cách độc lập rằng acid sulphovinic có thể được phân rã thành ethanol. Do vậy, năm 1825 Faraday đã vô tình phát hiện ra ethanol có thể được tạo ra từ ethylen (thành phần của khí than) từ việc hydrat hóa xúc tác acid, một quá trình tương tự hiện được dùng để tổng hợp ethanol quy mô công nghiệp.
- Ethanol đã từng được dùng làm nhiên liệu đốt đèn ở Hoa Kỳ khoảng năm 1840, nhưng thuế đánh vào cồn công nghiệp trong cuộc nội chiến làm cho việc sử dụng này không có tính kinh tế. Thuế đã được thay thế năm 1906. Ethanol được sử dụng làm nhiên liệu động cơ vào khoảng năm 1908, khi đó Ford Model T có thể chạy bằng xăng hoặc ethanol. Ethanol được sử dụng trong công nghiệp thường được sản xuất từ ethylen.
-
Tính chất vật lý
- Rượu ethylic là một chất lỏng, không màu, trong suốt, không mùi và đặc trưng, vị cay, nhẹ hơn nước (khối lượng riêng 0,7936 g/ml ở 15 độ C), dễ bay hơi (sôi ở nhiệt độ 78,39 độ C), hóa rắn ở -114,15 độ C, tan trong nước vô hạn, tan trong ether và chloroform, hút ẩm, dễ cháy, khi cháy không có khói và ngọn lửa có màu xanh da trời. Sở dĩ rượu ethylic tan vô hạn trong nước và có nhiệt độ sôi cao hơn nhiều so với ester hay aldehyde có khối lượng phân tử xấp xỉ là do sự tạo thành liên kết hydro giữa các phân tử rượu với nhau và với nước.
- Ethanol có tính khúc xạ hơi cao hơn so với của nước, với hệ số khúc xạ là 1,36242 (ở λ=589,3 nm và 18,35 °C).
- Điểm ba trạng thái của ethanol là 150 K ở áp suất 4,3 × 10−4 Pa.
-
Tính chất dung môi
- Ethanol là một dung môi linh hoạt, có thể pha trộn với nước và các dung môi hữu cơ khác như acid acetic, acetone, benzen, carbon tetrachlorua, chloroform, diethyl ether, ethylen glycol, glycerol, nitromethan, pyridin và toluen.Nó cũng có thể trộn với các hydrocarbon béo nhẹ như pentan và hexan, và với các chloride béo như trichloroethan và tetrachloroethylen.
- Tính hòa tan của ethanol với nước trái ngược với tính không thể trộn lẫn của các chất cồn có chuỗi dài hơn (có từ 5 nguyên tử cacbon trở lên), tính chất không thể trộn lẫn này giảm mạnh khi số nguyên tử carbon tăng. Sự trộn lẫn của ethanol với các ankan chỉ xảy ra ở những ankan đến undecan, hòa trộn với dodecan và các ankan cao hơn thể hiện một khoảng cách trộn lẫn ở một nhiệt độ nhất định (khoảng 13 °C đối với dodecan). Khoảng cách trộn lẫn có khuynh hướng rộng hơn với các ankan cao hơn và nhiệt độ cao hơn để tăng tính hòa trộn toàn bộ.
- Hỗn hợp ethanol-nước có thể tích nhỏ hơn tổng thể tích thành phần với một tỷ lệ nhất định. Khi trộn lẫn cùng một lượng ethanol và nước chỉ tạo thành 1,92 thể tích hỗn hợp. Hỗn hợp ethanol và nước có tính tỏa nhiệt với lượng nhiệt lên đến 777 J/mol ở nhiệt độ 298 K (25 độ C).
- Hỗn hợp ethanol và nước tạo thành một azeotrope với tỉ lệ mol 89% ethanol và 11% mol nước hay một hỗn hợp 96% thể tích ethanol và 4% nước ở áp suất bình thường và nhiệt độ 351 K. Thành phần azeotropic này phụ thuộc rất lớn vào nhiệt độ và áp suất và biến mất ở nhiệt độ dưới 303 K.
-
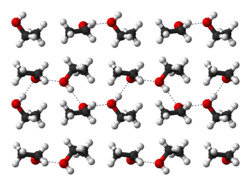
Liên kết hydro trong ethanol rắn ở nhiệt độ −186 ° C - Các liên kết hydro làm cho ethanol nguyên chất có tính hút ẩm, làm chúng sẵn sàng hút hơi nước trong không khí. Sự phân cực tự nhiên của nhóm chức hydroxyl làm cho ethanol có thể hòa tan một số hợp chất ion như natri và kali hydroxide, magnesi chloride, calci chloride, ammonium chloride, ammoni bromide, và natri bromide. Natri và kali chloride ít tan trong ethanol do phân tử ethanol có một đầu không phân cực, nó cũng sẽ hòa tan các hợp chất không phân cực, bao gồm hầu hết tinh dầu và nhiều chất hương liệu, màu, và thuốc.
-
Tính chất hóa học

Tính chất hóa học của ethanol được quyết định bới cấu trúc phân tử -
Tính chất của một rượu đơn chức
- Phản ứng thế với kim loại kiềm, kim loại kiềm thổ. Ví dụ:
- {\displaystyle {\ce {2C2H5OH + 2 Na -> 2C2H5ONa + H2}}}
- Phản ứng este hóa, phản ứng giữa rượu và acid với môi trường là acid sulfuric đặc nóng tạo ra ester. Ví dụ:
- {\displaystyle {\ce {C2H5OH + CH3COOH -> CH3COOC2H5 + H2O}}}
- Phản ứng loại nước như tách nước trong một phân tử để tạo thành olefin, trong môi trường acid sulfuric đặc ở 170 độ C:
- {\displaystyle {\ce {C2H5OH ->[H_2SO_4,dense][170^oC] C2H4 + H2O}}}
- Hay tách nước giữa 2 phân tử rượu thành ether
- {\displaystyle {\ce {C2H5OH + C2H5OH -> C2H5-O-C2H5 + H2O}}}
- Phản ứng oxy hóa, trong đó rượu bị oxy hóa theo 3 mức: (hữu hạn) thành aldehyde, acid hữu cơ và oxy hóa hoàn toàn (đốt cháy) thành CO2 và H2O. Ví dụ ở mức 1, trong môi trường nhiệt độ cao
- {\displaystyle {\ce {CH3-CH2-OH + CuO -> CH3-CHO + Cu + H2O}}}
- Mức 2, có xúc tác men giấm:
- {\displaystyle {\ce {CH3-CH2-OH + O2 ->[{}][{}] CH3-COOH + H2O}}}
- Mức 3:
- {\displaystyle {\ce {C2H5OH + 3O2 -> 2CO2 + 3H2O}}}
-
Phản ứng riêng
- Phản ứng tạo ra butadien-1,3: cho hơi rượu đi qua chất xúc tác hỗn hợp, ví dụ Cu + Al2O3 ở 380-400 độ C, lúc đó xảy ra phản ứng tách loại nước
- 2C2H5OH -> CH2=CH-CH=CH2 + 2 H2O + H2
- Phản ứng lên men giấm: oxy hóa rượu ethylic 10 độ bằng oxi không khí có mặt men giấm ở nhiệt độ khoảng 25 độ C.
- CH3-CH2-OH + O2 -> CH3-COOH + H2O
-
Một số tính chất khác
-
Tính chất Giá trị Số UN 1170 Nhiệt độ tan 158,8 K (-114,3°C, -173,83°F) Điểm tới hạn 514 K (241 °C, 465.53 °F) ở áp suất 63 bar ΔtanH 4,9 kJ/mol ΔtanS 31 J/mol•K ΔsôiH 38,56 kJ/mol pH 7,0 (trung tính) ΔfH0lỏng -277,38 kJ/mol S0lỏng 159,9 J/mol•K Cp 112,4 J/mol•K ΔfH0khí -235,3 kJ/mol S0khí 283 J/mol•K Cp 65,21 J/mol•K Tác động cấp tính Buồn nôn, gây mửa, gây trầm cảm. Ngừng thở trong trường hợp nặng. Tác động kinh niên Nghiện. Xơ gan. Nhiệt độ tự cháy 425 °C (797 °F) Mật độ giới hạn nổ 3,5-15% Tính chất khác (tiếng Anh) NIST WebBook -
Sản xuất
-

Ethanol 94% “biến tính” được bán trong các chai lọ an toàn để sử dụng trong gia đình-không dùng để uống - Ethanol được sản xuất bằng cả công nghiệp hóa dầu, thông qua công nghệ hydrat hóa ethylen, và theo phương pháp sinh học, bằng cách lên men đường hay ngũ cốc với men rượu.
-
Hydrat hóa ethylen
- Ethanol được sử dụng như là nguyên liệu công nghiệp và thông thường nó được sản xuất từ các nguyên liệu dầu mỏ, chủ yếu là thông qua phương pháp hydrat hóa ethylen bằng xúc tác acid, được trình bày theo phản ứng hóa học sau. Cho ethylen hợp nước ở 300 độ C, áp suất 70-80 atm với chất xúc tác là acid tungstic hoặc acid phosphoric:
- {\displaystyle {\ce {H2C=CH2 + H2O -> CH3CH2OH}}}
- Chất xúc tác thông thường là acid phosphoric, được hút bám trong các chất có độ xốp cao chẳng hạn như điatomit (đất chứa tảo cát) hay than củi; chất xúc tác này đã lần đầu tiên được công ty dầu mỏ Shell sử dụng để sản xuất ethanol ở mức độ công nghiệp năm 1947. Các chất xúc tác rắn, chủ yếu là các loại oxide kim loại khác nhau, cũng được đề cập tới trong các sách vở hóa học.
- Trong công nghệ cũ, lần đầu tiên được tiến hành ở mức độ công nghiệp vào năm 1930 bởi Union Carbide, nhưng ngày nay gần như đã bị loại bỏ thì ethylen đầu tiên được hydrat hóa gián tiếp bằng phản ứng của nó với acid sulfuric đậm đặc để tạo ra ethyl sulfat, sau đó chất này được thủy phân để tạo thành ethanol và tái tạo acid sulfuric:
- H2C=CH2 + H2SO4 → CH3CH2OSO3H
- CH3CH2OSO3H + H2O → CH3CH2OH + H2SO4
- Ethanol để sử dụng công nghiệp thông thường là không phù hợp với mục đích làm đồ uống cho con người (“biến tính”) do nó có chứa một lượng nhỏ các chất có thể là độc hại (chẳng hạn methanol) hay khó chịu (chẳng hạn denatonium- C21H29N2O•C7H5O2-là một chất rất đắng, gây tê). Ethanol biến tính có số UN là UN 1987 và ethanol biến tính độc hại có số là UN 1986.
-
Lên men
- Ethanol để sử dụng trong đồ uống chứa cồn cũng như phần lớn ethanol sử dụng làm nhiên liệu, được sản xuất bằng cách lên men: khi một số loài men rượu nhất định (quan trọng nhất là Saccharomyces cerevisiae) chuyển hóa đường trong điều kiện không có oxy (gọi là yếm khí), chúng sản xuất ra ethanol và carbon dioxide CO2. Phản ứng hóa học tổng quát có thể viết như sau:
- C6H12O6 → 2 CH3CH2OH + 2 CO2
- Quá trình nuôi cấy men rượu theo các điều kiện để sản xuất rượu được gọi là ủ rượu. Men rượu có thể phát triển trong sự hiện diện của khoảng 20% rượu, nhưng nồng độ của rượu trong các sản phẩm cuối cùng có thể tăng lên nhờ chưng cất.
- Để sản xuất ethanol từ các nguyên liệu chứa tinh bột như hạt ngũ cốc thì tinh bột đầu tiên phải được chuyển hóa thành đường. Trong việc ủ men bia, theo truyền thống nó được tạo ra bằng cách cho hạt nảy mầm hay ủ mạch nha. Trong quá trình nảy mầm, hạt tạo ra các enzyme có chức năng phá vỡ tinh bột để tạo ra đường. Để sản xuất ethanol làm nhiên liệu, quá trình thủy phân này của tinh bột thành glucose được thực hiện nhanh chóng hơn bằng cách xử lý hạt với acid sulfuric loãng, enzyme nấm amylase, hay là tổ hợp của cả hai phương pháp.
- Về tiềm năng, glucose để lên men thành ethanol có thể thu được từ cellulose. Việc thực hiện công nghệ này có thể giúp chuyển hóa một loại các phế thải và phụ phẩm nông nghiệp chứa nhiều cellulose, chẳng hạn lõi ngô, rơm rạ hay mùn cưa thành các nguồn năng lượng tái sinh. Cho đến gần đây thì giá thành của các enzyme cellulase có thể thủy phân cellulose là rất cao. Hãng Iogen ở Canada đã đưa vào vận hành xí nghiệp sản xuất ethanol trên cơ sở cellulose đầu tiên vào năm 2004.
- Phản ứng thủy phân cellulose gồm các bước. Bước 1, thủy phân cellulose thành maltose dưới tác dụng của men amylase.
- (C6H10O5)n -> C12H22O11
- Bước 2, thủy phân tiếp maltose thành glucose hoặc fructose dưới tác dụng của men maltase.
- C12H22O11 -> C6H12O6
- Bước 3, phản ứng lên men rượu có xúc tác là men zima.
- C6H12O6 -> 2 C2H5OH + 2 CO2
- Với giá dầu mỏ tương tự như các mức giá của những năm thập niên 1990 thì công nghệ hydrat hóa ethylen là kinh tế một cách đáng kể hơn so với công nghệ lên men để sản xuất ethanol tinh khiết. Sự tăng cao của giá dầu mỏ trong thời gian gần đây, cùng với sự không ổn định trong giá cả nông phẩm theo từng năm đã làm cho việc dự báo giá thành sản xuất tương đối của công nghệ lên men và công nghệ hóa dầu là rất khó.
-
Làm tinh khiết
- Đối với hỗn hợp ethanol và nước, điểm sôi hỗn hợp (azeotrope) cực đại ở nồng độ 96% ethanol và 4% nước. Vì lý do này, chưng cất phân đoạn hỗn hợp ethanol-nước (chứa ít hơn 96% ethanol) không thể tạo ra ethanol tinh khiết hơn 96%. Vì vậy, 95% ethanol trong nước là dung môi phổ biến nhất.
- Chưng cất phân đoạn là một trong những phương pháp kinh điển dùng để tách các chất bay hơi ra khỏi một hỗn hợp dựa vào sự khác biệt nhiệt độ sôi của các chất trong hỗn hợp. Quá trình chưng cất có thể thực hiện ở áp suất khí quyển hay áp suất giảm. Phương pháp chưng cất phân đoạn được thực hiện với những bình cất có lắp cột phân đoạn và thường được nối với máy hút chân không để giảm nhiệt độ chưng cất, giảm ảnh hưởng tới các chất nhạy cảm với nhiệt độ. Nhiệt độ và áp suất được theo dõi trong quá trình chưng cất. Phương pháp này thường áp dụng để tách các chất thành phần của tinh dầu.
- Hai hướng cạnh tranh nhau có thể sử dụng trong sản xuất ethanol tinh chất. Để phá vỡ điểm sôi hỗn hợp nhằm thực hiện việc chưng cất thì một lượng nhỏ benzen có thể thêm vào, và hỗn hợp lại được chưng cất phân đoạn một lần nữa. Benzen tạo ra điểm sôi hỗn hợp cấp ba với nước và ethanol nhằm loại bỏ ethanol ra khỏi nước, và điểm sôi hỗn hợp cấp hai với ethanol loại bỏ phần lớn benzen. Ethanol được tạo ra không chứa nước. Tuy nhiên, một lượng rất nhỏ (cỡ phần triệu benzen vẫn còn, vì thế việc sử dụng ethanol đối với người có thể gây tổn thương cho gan.
- Ngoài ra, sàng phân tử có thể sử dụng để hấp thụ có chọn lọc nựớc từ dung dịch 96% ethanol. Zeolit tổng hợp trong dạng viên tròn có thể sử dụng, cũng như là bột yến mạch. Hướng tiếp cận bằng zeolit là đặc biệt có giá trị, vì có khả năng tái sinh zeolit trong hệ khép kín về cơ bản là không giới hạn số lần, thông qua việc làm khô nó với luồng hơi CO2 nóng. Ethanol tinh chất được sản xuất theo cách này không có dấu tích của benzen, và có thể sử dụng như là nhiên liệu hay thậm chí khi hòa tan có thể dùng để làm mạnh thêm các loại rượu như rượu vang pooctô (có nguồn gốc ở Bồ Đào Nha hay rượu vang sherry (có nguồn gốc ở Tây Ban Nha) trong các hoạt động nấu rượu truyền thống.
- THÔNG TIN CẦN BIẾT: TINH DẦU THIÊN NHIÊN I⇒ DẦU NỀN I⇒ TIN KHUYẾN MÃI I⇒ BẢNG GIÁ SẢN PHẨM I⇒ LIÊN HỆ 0932 696 777
Sản phẩm liên quan
120.000₫ - 1.650.000₫150.000₫ 120.000₫
Tiết kiệm: 30.000₫ (20%)
90.000₫ - 2.000.000₫150.000₫ 90.000₫
Tiết kiệm: 60.000₫ (40%)
Chia sẻ :



![{\displaystyle {\ce {C2H5OH ->[H_2SO_4,dense][170^oC] C2H4 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/217b9511f4fcbec4436855ab445a152a25158141)


![{\displaystyle {\ce {CH3-CH2-OH + O2 ->[{}][{}] CH3-COOH + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1d6320912ba1fe56040479262fe6e8e67aa5225)



